Samfunnsspeilet, 2007/3
Mammografiscreeningen
Mest til skade?
Published:
I Sverige og Norge har mammografiscreeningen ført til at hyppigheten av brystkreft har økt sterkt i de screenede aldersgruppene, men screeningen har ikke redusert brystkrefthyppigheten i høyere alder og har ikke hatt effekt på brystkreftdødeligheten i befolkningen.
- Series archive
- Samfunnsspeilet, 2007/3
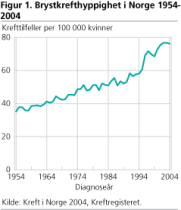
Brystkreft er den vanligste kreftformen hos kvinner. I 2004 ble det påvist om lag 2 800 nye tilfeller, og rundt 700 døde av sykdommen. Tall fra Kreftregisteret viser at brystkrefthyppigheten eller insidensen (se definisjon i tekstboks) har vært jevnt stigende fra 1954. Insidensen øker med alder. Tidlig menstruasjonsstart er forbundet med økt insidens, mens tidlig graviditet og mer enn en graviditet er forbundet med lavere insidens.
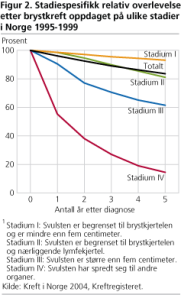
Dødelig sykdomsforløp ved kreftsykdom skyldes ofte at det oppstår dattersvulster (metastaser) i vitale organer som lunger, lever og hjerne. Sannsynligheten for å finne dattersvulster øker med størrelsen på morsvulsten. Av kvinner som fikk diagnostisert kreft uten spredning (stadium 1) i perioden 1995-1999, var 93 prosent fortsatt i live fem år etter at de fikk diagnosen. Av dem som fikk diagnostisert sykdommen med spredning til vitale organer (stadium 4), var bare 15 prosent i live fem år etter. Målet med tidligdiagnostikk av kreftsykdom er derfor å behandle svulsten før den har spredt seg.
Helt fra 1950-tallet har man anbefalt selvundersøkelse som metode for å kunne oppdage svulster tidlig, men slike anbefalinger har manglet et godt vitenskapelig grunnlag. To store randomiserte studier fra Russland og Kina viser klart at selvundersøkelse ikke reduserer risikoen for å dø av brystkreft. I stedet fører selvundersøkelse til overbehandling i form av en markant økning i antall brystoperasjoner (Koesters og Gøtzsche 2003).
Ved røntgenundersøkelse av brystene (mammografi) kan man påvise svulster før de kan oppdages ved manuell undersøkelse. På 1970- og 1980-tallet kom syv randomiserte (se definisjon i tekstboks) studier som til sammen tydet på at regelmessige undersøkelser med mammografi reduserer brystkreftdødeligheten. Dette førte til at mange land innførte mammografiscreening. Sverige startet i 1986 og screeningen var landsdekkende fra tidlig på 1990-tallet. Norge startet i 1996 og screeningen her var landsdekkende fra 2004.
Gøtzsche og Nielsen har nylig oppdatert en oversikt over de randomiserte mammografistudiene. De konkluderte med at selv om det ser ut til at screening kan gi en moderat dødelighetsreduksjon (15-20 prosent), så er dette usikkert, fordi det meste av reduksjonen ville ha forsvunnet om man hadde valgt å se bort fra de dårligste studiene. Dessuten viste alle studiene at screening fører til betydelig overdiagnostikk, det vil si påvisning av svulster som i fravær av screening ikke ville ha blitt diagnostisert i kvinnenes levetid. Disse kvinnene er altså friske og får kreftbehandling uten å trenge det. Gøtzsche og Nielsen hevder at for hver kvinne som reddes fra å dø av brystkreft vil ti friske kvinner få kreftdiagnose og kreftbehandling uten at de har reell kreftsykdom (Gøtzsche og Nielsen 2006). Nedenfor diskuterer vi om resultatene fra de nasjonale screeningprogrammene har gitt støtte for disse alvorlige konklusjonene.
Screeningen påviser brystkrefttilfeller, som enten må være tidligdiagnostikk eller overdiagnostikk
Ved oppstart av organisert mammografiscreening forventer man en økning i antall diagnostiserte brystkrefttilfeller, blant annet fordi mammografi kan oppdage svulster før de kan påvises ved klinisk undersøkelse. I de aller fleste screeningprogrammene ser det ut til at hyppigheten av brystkreft øker med om lag 50 prosent i populasjonen som inviteres til screening. Hvis hele denne økningen skyldes tidligdiagnostikk, skulle man forvente et tilsvarende fall i brystkrefthyppigheten når kvinnene passerer øvre aldersgrense for innkalling (Boer med flere 1994).
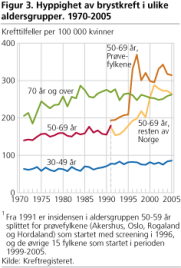
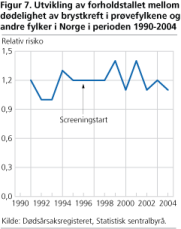
I Norge startet den organiserte mammografiscreeningen i 1996 som et prøveprosjekt i Akershus, Hordaland, Oslo og Rogaland (40 prosent av landets befolkning) og er senere gradvis utvidet til å bli landsomfattende. Kvinnene innkalles hvert annet år fra de er 50 til de er 69 år. Figur 3 viser brystkrefthyppigheten i prøvefylkene og resten av Norge i perioden 1990-2004. Gjennomsnittlig hyppighet av brystkreft i de fire fylkene i perioden 1991-1995 var 200 per 100 000.
Frammøte i første screeningrunde var om lag 80 prosent av de inviterte, og andelen har i senere runder ligget mellom 70 og 80 prosent. Brystkrefthyppigheten (ikke medregnet forstadier, eller duktalt carcinoma in situ, se tekstboks) i første screeningrunde var 364 per 100 000. I andre, tredje og fjerde screeningrunde var brystkrefthyppigheten henholdsvis 308 per 100 000, 304 per 100 000 og 315 per 100 000. Hvis duktalt carcinoma in situ inkluderes, var brystkrefthyppigheten over 350 per 100 000 i andre, tredje og fjerde screeningrunde. Brystkrefthyppigheten er altså stabil fra og med andre screeningrunde. Etter første screeningrunde (prevalensscreeningen, den som fanger opp både gamle og nye svulster) har dermed brystkrefthyppigheten ligget over 50 prosent høyere enn i perioden før screeningen startet.
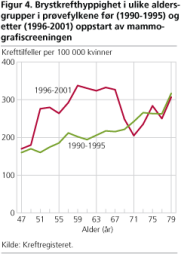
Vi fant at hos kvinner som velger å ikke møte til screening, var brystkrefthyppigheten nesten identisk med det den var i hele populasjonen i perioden 1990-1995 (200 per 100 000) (Zahl og Mæhlen 2004). Det tyder på at all økning i brystkrefthyppighet sees hos kvinnene som møter til screening. Med andre ord, i fravær av screening ville brystkrefthyppigheten antagelig ha vært tilnærmet stabil og uforandret i perioden 1996-2001. Når vi inkluderer duktalt carcinoma in situ, som nesten bare oppdages ved screening, er hyppigheten av brystkreft tilnærmet fordoblet hos dem som møter til screening (394 per 100 000) i forhold til hele populasjonen i femårsperioden før screening.
Halvparten av den forventede kreftforekomsten (200 per 100 000) utgjøres av intervallkreft (kreft som blir oppdaget mellom to screeningrunder), 100 per 100 000. Den andre halvparten inngår i insidensen av invasiv kreft påvist ved screening.
Fordi det bare er en kortvarig og moderat reduksjonen i kreftforekomsten når kvinnene ikke lenger innkalles fordi de passerer aldersgrensen ved fylte 70 år, kan hele hyppighetsøkningen fra og med andre screeningrunde betraktes som overdiagnostikk (Zahl, Strand og Mæhlen 2004). Det betyr at de 394 krefttilfellene per 100 000 (forstadiene er inkludert) fordeler seg slik: 200 er reell kreft og av disse vil 100 påvises ved screening mens de øvrige 100 vokser så raskt at de dukker opp i toårsperioden mellom to screeningundersøkelser. De øvrige 194 oppdages ved screening og er overdiagnostiserte tilfeller. Med andre ord: omtrent 2 av 3 diagnoser (194 av 294) som stilles ved screening, er overdiagnoser Og når en kvinne velger å møte til screening fordobler hun sin risiko for å få brystkreftdiagnose (hyppigheten øker fra 200 per 100 000 til 394 per 100 000).
At brystkrefthyppigheten holder seg på et høyt nivå screeningrunde for screeningrunde, må bety at det stadig nydannes langt flere svulster enn det som gir seg til kjenne klinisk i fravær av screening. Svulster som ikke gir seg til kjenne klinisk, må enten hope seg opp hos kvinnene eller forsvinne av seg selv. Hvis de hoper seg opp, betyr det at det skulle være et skjult reservoar av ikke-symtomgivende (subklinisk) brystkreft hos eldre kvinner som ikke har gått til screening. Men førstegangsscreening med mammografi av eldre kvinner, har vist at det ikke eksisterer et slikt subklinisk kreftreservoar. Det må bety at disse svulstene i fravær av screening, tilbakedannes av seg selv. Tallmaterialet som denne slutningen er basert på, er stort og omfattende, men likevel er det vanskelig å få aksept for ideen om kreft som forsvinner av seg selv. Vi kan se to åpenbare årsaker til det. For det første bryter ideen med det dominerende synet på hva kreft er. De fleste vil hevde at kreftsykdom som er bekreftet ved patologisk undersøkelse, er en irreversibel tilstand som gjenspeiler irreversible mutasjoner i kreftcellenes gener. For det andre betyr det å akseptere denne ideen at man samtidig aksepterer at insidensøkningen i screeningprogrammet er overdiagnostikk i stedet for tidligdiagnostikk. Dermed har man erkjent at det ikke er grunnlag for å tro at screening medfører tidligere behandling av reell kreft. Og at man ikke kan forvente at screening vil gi dødelighetsreduksjon.
Brystkreftdødeligheten er redusert, men screening har ikke bidratt
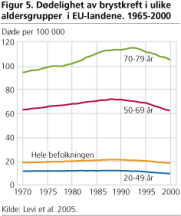
Fra 1990 har dødeligheten av brystkreft falt i mange land (Levi F med flere 2005). Dette fallet kan ikke alene skyldes screening, fordi dødelighetsreduksjonen kom i land både med og uten mammografiscreening. Dessuten har dødelighetsreduksjonen vært mest markant i aldersgruppen under 50 år, som i de fleste nasjonale screeningprogrammene ikke innkalles. Det er i stedet sannsynlig at dødelighetsreduksjonen skyldes introduksjon av moderne hormonblokkere og mer effektiv cellegiftbehandling.
Sverige og Norge har historisk hatt nesten identiske dødelighetsrater for de fleste sykdommer inkludert brystkreft i over 50 år. Det er dermed logisk å sammenligne trender i dødelighetsutviklingen for brystkreft i de to landene. I de randomiserte mammografistudiene som til sammen inkluderte noen få hundre tusen kvinner, var dødelighetsreduksjonen klart synlig 5-7 år etter screeningstart. Hvis screeningen har medført en reduksjon som er større enn 10 prosent i dødeligheten, burde dette være klart synlig i det langt større datamaterialene fra Sverige og Norge.
Analysene av de tidligere studiene viser at mammografi antagelig ikke reduserer dødeligheten med mer enn 15-20 prosent (Gøtzsche og Nielsen 2006). Vi har undersøkt om det har vært forskjellige dødelighetstrender mellom Sverige, som startet screening fra 1986, og Norge som startet mammografiscreening fra 1996. Det var bare små forskjeller i dødelighetsutviklingen i de to landene og forskjellene har neppe sammenheng med mammografiscreeningen. Det var for eksempel ikke slik at dødelighetsreduksjonen kom tidligere i de svenske fylkene som var tidligst ute med screening. Ved å undersøke dødelighetsutviklingen fylkesvis fra screeningstart fant vi heller ikke tegn til et felles knekkpunkt i dødelighetsutviklingen 5-7 år etter screeningstart, slik det så ut til å være i noen av de randomiserte studiene. Endelig fant vi ingen tegn til redusert dødelighet av brystkreft i Akershus, Hordaland, Oslo og Rogaland sammenlignet med resten av Norge i perioden 1996-2004.
Konklusjoner
Tall fra kreftregistrene i Norge og Sverige viser at mammografiscreening fører til overdiagnostisering av brystkreft i langt større grad enn det analysene av de randomiserte studiene tydet på.
I forhold til tidligere medfører landsdekkende mammografiscreening at nesten 1 000 flere norske kvinner årlig behandles for invasiv brystkreft og kreftforstadier. Det meste av dette er overdiagnostikk. At nivået av overdiagnostiseringen er på samme nivå i andre og tredje screeningrunde synes å indikere at slike lesjoner stadig oppstår for deretter å tilbakedannes av seg selv.
Til tross for landsdekkende screening i Sverige i over 15 år er de aldersjusterte dødelighetsratene av brystkreft i aldersgruppen 55-74 år og andre aldersgrupper tilnærmet identisk med ratene i Norge.
Det er heller ikke tegn til redusert dødelighet i de fire norske fylkene som startet screening i 1996.
Dette tyder på at screening ikke gir noen reduksjon i risikoen for å dø av brystkreft.
Referanser
Kosters JP og PC Gøtzsche (2003): Regular self-examination or clinical examination for early detection of breast cancer. Cochrane
Database
System Review. 2003;(2):CD003373. Review.
Gøtzsche, PC og M. Nielsen (2006): Screening for breast cancer with mammography.
Cochrane Database System Review. 2006 Oct 18;(4):CD001877. Review.
Boer R, P. Mamerdam, H. de Koning og G. van Oortmarssen (1994): Extra incidence caused by mammographic screening. Lancet 1994;343: 979.
Levi, F C. Bosetti, F. Lucchini, E. Negri og C. La Vecchia (2005): European Journal of Cancer Prevention 2005;14:497-502.
Zahl P.H. og J. Mæhlen (2004): Overdiagnostisering ved mammografiscreening, Tidsskrift for Den norske lægeforening 2004; 124: 2238-9.
Zahl PH, B.H. Strand og J. Mæhlen (2004): Breast cancer incidence in Norway and Sweden during introduction of nation-wide screening: prospective cohort study. British Medical Journal 2004; 328: 921-4.
Jan Mæhlen er overlege og professor 2 ved Patologisk-anatomisk avdeling Ullevål universitetssykehus. Han er tilknyttet Dødsårsaksregisteret som medisinsk konsulent. (jan.mahlen@medisin.uio.no).
Per-Henrik Zahl er dr. med og seniorstatistiker ved Nasjonalt folkehelseinstitutt (Per-Henrik.Zahl@fhi.no).
Contact
-
Statistics Norway's Information Centre